
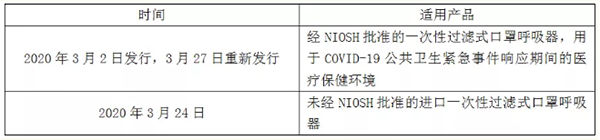
美国食品药品监督管理局(FDA)早在今年(2020年)2月初就为了应对各类医疗器械的紧缺,发布了各类EUA(应急使用授权),在今年3月27号发布了个人防护设备的EUA认证。
紧急使用授权(EUA)授权FDA通过促进在公共卫生紧急情况下所需的MCM的可用性和使用,帮助FDA加强针对CBRN威胁的国家公共卫生保护。
根据《联邦食品,药物和化妆品法》(FD&C Act)第564 条,FDA专员可以允许未经批准的医疗产品或未经批准的批准使用的医疗产品用于紧急情况,以诊断,治疗或预防严重或生命危险-如果没有足够的,已批准的和可用的替代方法,则由CBRN威胁因子引起的威胁性疾病或状况。
正如CDC优化呼吸器供应策略中所述,其他国家/地区也根据标准批准了呼吸器。这些设备使用类似于NIOSH的方法进行评估,并且由于COVID-19大流行导致FFR不足,仍有望为医护人员提供足够的保护。在这种情况下,FDA认为在由COVID-19大流行引起的短缺期间,这些设备可以作为个人呼吸防护的合适替代品。
注:EUA授权的口罩均不用于个人,只能是医护人员。

包括:呼吸机EUA认证;个人防护装备EUA认证;体外诊断EUA认证;
产品面向医用市场,则产品满足以下标准或者认证即可
1、欧盟CE认证;
2、澳大利亚ARTG;
3、加拿大Health Canada Licence;
4、日本PMDA/MHLW。
或以下相关标准:
1、Australia AS/NZS 1716:2012 P3,P2;
2、Brazil ABNT/NBR 13698:2011 PFF3,PFF2;
3、Europe EN 149-2001 FFP3,FFP2;
4、Japan JMHLW-2000 DS/DL3 DS/DL2;
或者直接获得美国NIOSH认证(限以下三种类型)
1、无动力空气净化颗粒FFR和可重复使用的呼吸器,例如,NIOSH根据42 CFR Rart 84批准并列于NIOSH认证设备清单(CEL)中的无动力空气净化器 具有颗粒防护的呼吸器;
2、经NIOSH批准的其他电动空气净化呼吸器(PAPR),符合42 CFR第84部分的规定,并列在NIOSH CEL上的具有颗粒防护的PAPR上;
3、经NIOSH批准但已通过制造商建议的保质期的FFR,未损坏,并且已由制造商按照HCP的要求在制造商的医疗场所使用。
产品面向个人市场,则产品应获得NIOSH认证
CDC优化呼吸器供应策略中推荐的NIOSH替代标准,除了国内标准:GB 2626-2006外,其他均被EUA采纳。即使中国标准口罩被认为可以提供给个人使用,但目前必须再通过NIOSH认证。
有产品办理检测认证或想了解更多详情资讯,请联系宝测达检测中心!

《产品资料准备齐全,快速办理EUA认证》
宝测达检测机构(POCE)是国际领先的从事工业与消费产品检测认证机构。为国内外企业提供电磁兼容EMC、安全和无线电射频测试,化学检测,电池检测,ISO体系, 分析整改等综合服务,协助客户快速完成EUA认证,咨询:13802284723。






