口罩是一种卫生用品,戴在口鼻部位用于过滤进入口鼻的空气,以达到阻挡有害的气体、气味、飞沫进出佩戴者口鼻的用具,以无纺布等制成。
口罩分为医用口罩、工业防护口罩、民用口罩三个大类。其应用场景、主要特点、执行标准、制作工艺均存在较多不同。医用口罩产品一般由三层无纺布制成,其中外层为纺粘无纺布,经防水处理,采用防飞沫设计,阻隔体液、血液等液体;中层为熔喷无纺布,通常采用经过驻极处理的聚丙烯熔喷无纺布,为过滤层核心;内层主要使用ES无纺布,具有较好的吸湿功能。

口罩出售要严格符合国家及其它地区的相关标准
国际口罩检测标准
ISO 22609:2004 传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积,水平注射)。
欧盟口罩检测标准
EN 136-1998 呼吸保护装置.全面罩.要求,试验,标记;
EN 140-1998+AC-1999 呼吸保护装置.半面罩和四分之一面罩.要求,试验和标记;
EN 143-2000 呼吸防护装置.微粒过滤器.要求,试验,标记;
EN 149-2001 呼吸防护装置.颗粒防护用过滤半面罩.要求,检验和标记;
EN 529-2005 呼吸保护装置.选择,使用,保养和维修的建议;
EN 12942-1998 呼吸保护器.带全面罩,半面罩和四分之一面罩的鼓风过滤装置.要求,检验,标识;
EN 14387-2004+A1-2008 呼吸保护装置.气体过滤器和组合过滤器.要求、测试、标记;
EN 14683-2019 医用口罩 要求和试验方法。
美国口罩检测标准
ASTM F1862/F1862M-2017 医用口罩抗人工合成血渗透的标准试验方法(已知速度下固定体积的水平投影);
ASTM F2100-2019 医用口罩材料性能标准规范;
ASTM F2101-2019 用金黄色葡萄球菌生物气溶胶评价医用口罩材料的细菌过滤效率(BFE)的标准试验方法;
ASTM F2299/F2299M-2003(2017) 用胶乳球测定医用面具材料粒子渗透性初始效率的标准试验方法。
澳大利亚口罩检测标准
AS/NZS 1715:2009 呼吸保护设备的选择,使用和维护;
AS/NZS 1716:2012 呼吸保护装置。
日本口罩检测标准
JIS T 8062:2010 预防传染性病原体的防护服.面罩.防止人造血浆渗透的试验方法(确定容量,平行注射);
JIS T 8159:2006 呼吸防护设备的选择、使用和维护指南;
JIS T 8159:2006 呼吸保护装置泄漏率试验方法。
韩国口罩检测标准
KS M 6673-2008 防尘口罩;
KS K ISO 22609-2018 传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积、水平喷射)。
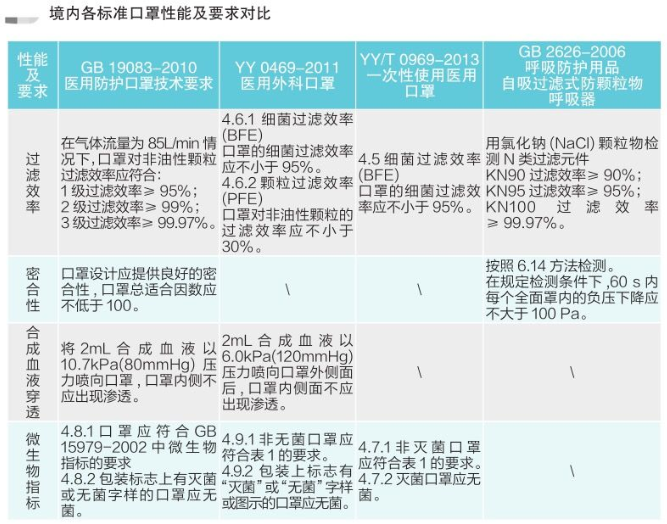
各国口罩技术标准对比(供生产企业参考)

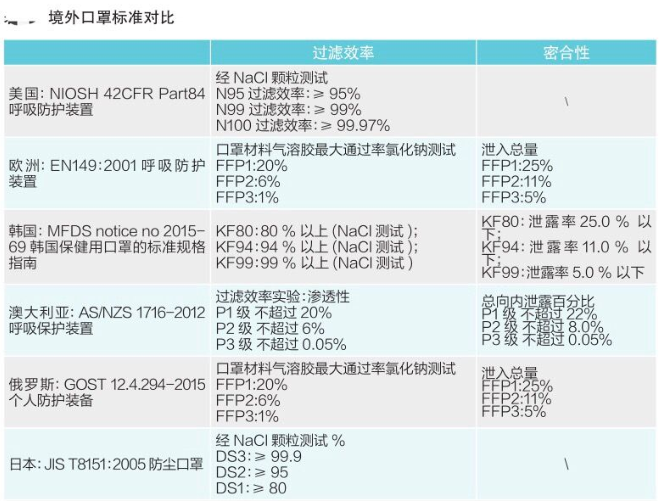
各国口罩准入条件
美国口罩准入条件
必要资料:提单,箱单,发票。
个人防护口罩:必须取得美国 NIOSH检测认证,即National Institute for Occupational Safety and Health美国国家职业安全卫生研究所认证。
医用口罩:须取得美国FDA注册许可。
欧盟口罩准入条件
必要资料:提单,箱单,发票。
个人防护口罩的欧盟标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别。所有出口欧盟的口罩必须获得CE认证证书。CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。
医用口罩对应的欧盟标准是EN14683。
产品在欧盟销售需要出具欧盟自由销售证书 Free Sale Certificate,有了CE标志并进行了相关指令中要求的欧盟注册后,中国的制造商出口欧盟不需要自由销售证书。
日本口罩准入条件
必要资料:提单,箱单,发票,日本国外的制造商必须向PMDA注册制造商信息。
口罩包装要求
包装上印有ウィルスカット(中文翻译:病毒拦截)99%的字样
PFE:0.1um微粒子颗粒过滤效率
BFE:细菌过滤率
VFE:病毒过滤率
口罩品质标准
1. 医用防护口罩:符合中国GB 19083-2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。
2. N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。
3. KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。
韩国口罩准入条件
必要资料:提单,箱单,发票,韩国进口商营业执照。
个人防护口罩标准:KF (Korean filter) 系列分为KF80、KF94、KF99。
执行标准规范
MFDS Notice No. 2015-69
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质
澳大利亚口罩准入条件
必要资料:提单,箱单,发票。
须通过澳洲的TGA注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸保护装置标准。
TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。
国内口罩出口需具备的资质和材料
1.营业执照(经营范围有相关经营内容)。
2.企业生产许可证(生产企业)。
3.产品检验报告(生产企业)。
4.医疗器械注册证(非医用不需要)。
5.产品说明书(跟着产品提供)、标签(随附产品提供)。
6.产品批次/号(外包装)。
7.产品质量安全书或合格证(跟着产品提供)。
8.产品样品图片及外包装图片。
9.须取得海关收发货人注册备案。






